Tractografía cerebral y neuroimagen tridimensional: Nuevas formas de ver el cerebro.
Aplicación en el Hipocampo de la Epilepsia Temporal
A.Gutiérrez, *V.Belloch, V.Villanueva
Unidad Multidisciplinar de Cirugía de la Epilepsia. Hospital la Fe Valencia. *ERESA
Uno de los desarrollos tecnológicos más prometedores aplicados a la Neurociencia en la última década ha sido la RM secuencia Tensor de Difusión llamada en el lenguaje coloquial RM de tractografía. Dicha técnica, nacida en el seno de la Radiología diagnóstica ha traspasado dicha utilidad clínica para convertirse en una poderosa herramienta de conocimiento de la estructura cerebral. En este contexto debemos de cambiar nuestra idea localizacionista focal del cerebro para adecuarnos el concepto de Red Cerebral.
La RM DTI supone por todo ello un cambio en la visión de las estructuras que conforman el sistema nervioso central. Dicha técnica no invasiva, permite la visualización y el análisis del cerebro basándose en la movilidad de la molécula de agua. [Le Biham (1), Pierpaoli (2), Basser (3-5) Jones (6), Fernandez-Miranda (7)]. Su aplicación en el campo de la Enfermedad de la Epilepsia del Lóbulo Temporal (ELT) cobra especial importancia, [Arfanakis (8), Diehl (9)] ya que permite analizar los cambios y alteraciones en la conectividad como sustrato de la ELT [Mori (10-12), Engel (13), Jack (14), Mikkonen (15) Melhem (16)].
En dicha patología cerebral distinguimos varios niveles de aplicabilidad de la RM-DTI: el análisis estructural que nos permite el diagnóstico clínico, su utilidad en la planificación quirúrgica de desconexión focal y el establecimiento de los posibles circuitos locales de propagación de las crisis comiciales sin olvidar los cambios generados en el cerebro operado.
1.-Diagnóstica
Evaluación sistema hipocampal en la Epilepsia Temporal.
La aproximación de la Neuroimagen de la RM a la estructura del hipocampo es posible aplicando los estudios DTI reinterpretando dichos hallazgos en clave histológica.
La aplicación de la RM-DTI en la Epilepsia temporal en el contexto de las nuevas terapias permite visualizar la estructura interna del hipocampo (Asta de Amon-GD). El hilio dada la especial organización en la conexión hipocampal intrínseca representa una de las estructuras determinantes y clave en los fenómenos de epiléptogénesis. Las proyecciones neuronales de las células de los Granos CG (pirámides pequeñas) al contactar con la región CA3 del Asta de Amón configuran el estrato Lúcido (descrito por Cajal). Dicha configuración corresponde a la disposición de las fibras musgosas de las CG constituyendo parte del circuito trisináptico hipocampal intrínseco. El grado de magnitud de dicha estructura alcanza el orden de 1mm. Dicho rango supone el límite de resolución de los equipos de RM-DTI 3T de uso clínico por lo que es posible su visualización y análisis. Fig.1
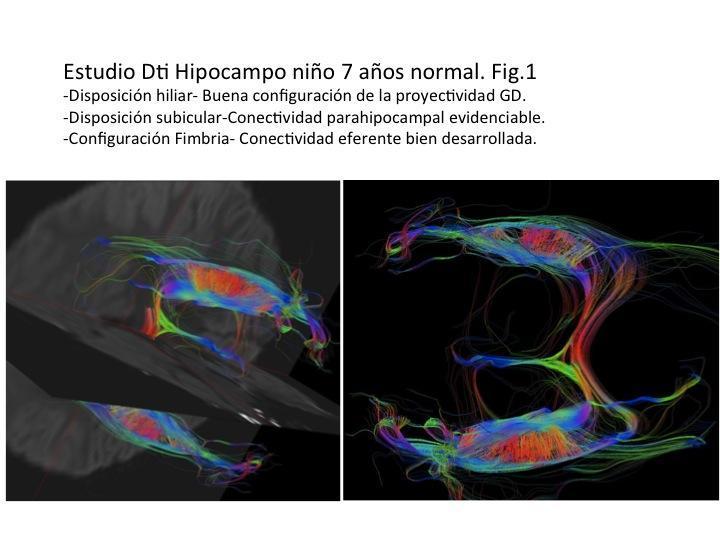
El carácter tridimensional inherente de la RM-DTI en el que se fundamenta (representa la movilidad multidimensional de la molécula de agua en un entorno cerebral), lo podemos aumentar incrementando su resolución mediante el análisis computacional de la direccionalidad de los tractos en la matriz cerebral y su posterior representación aplicando un Código de Colores (CC) mostrando dicha disposición tridimensional según su orientación. De esta manera es posible determinar las alteraciones estructurales presentes en la patología de la epilepsia temporal / hipocampal [Shepherd (17-18) Wieshmann (19)].
En la EM causada por la Epilepsia del Lóbulo Temporal, podemos evaluar los procesos de destrucción celular producidos por las crisis continuadas y los fenómenos de remodelación de las conexiones neuronales. Es a nivel del GD donde vamos a encontrar alteraciones significativas así como en la región subicular Sector CA4 y CA1. [Concha (20-21), Adachi (22), Alsop (23) Wittner (24), Maccaferri (25) y Soltesz (26) Lorente de Nó (27)]
Los patrones histopatológicos del Hipocampo con Esclerosis Mesial se establecen por la pérdida de los elementos celulares neuronales en todos los sectores del Asta de Amon con un patrón de desestructuración de la disposición de los estratos correspondientes al córtex correspondiente. Asimismo se evidencia una pérdida de la disposición laminar septo-temporal.
Mediante el análisis cuantitativo anisotrópico mediante DTI podemos analizar la Fracción de Anisotropía (FA) y el Índice de Difusibilidad (ADC). [Beauleu (28)] Asimismo podemos determinar el grado de conectividad parahipocampal aferente al hipocampo a través del subículo. Por otra parte debemos de evaluar las proyecciones predominantemente eferentes del sistema hipocampal conformando la fimbria para establecer su comunicación con estructuras septales e hipotalámicas. Finalmente los cambios en la conectividad extrínseca hipocampal procedente del tálamo han de ser analizados completando el sustrato estructural del sistema hipocampal.
El patrón morfológico presente en el hipocampo con Esclerosis Mesial y Epilepsia Temporal muestra una reducción muy importante en el número de Hilios del GD detectados, cambios en la disposición espacial de los mismos perdiendo la configuración laminada y orientación del hipocampo. Dichas alteraciones son más destacadas a nivel de la cabeza del hipocampo. Asimismo determinamos una reducción en la conectividad parahipocampal y entorrinal con imágenes de reforzamiento de tractos entorrinales; finalmente determinamos la desconexión hipocampo/parhipocampal. [Badd (29-33) y Sutula 34 Represa (35), Isokawa (36)]
La pérdida de la homogeneidad en la direccionalidad del hilio hipocampal con EM determina esta pérdida de anisotropía que el análisis DTI se establece como una disminución de la visualización de tractos en valores globales. Fig.2
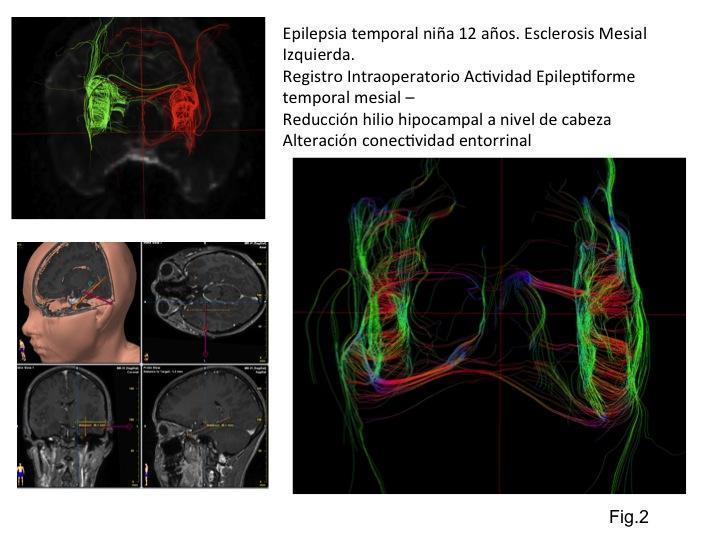
A nivel de la eferencia hipocampal que representa la fimbria hemos determinado en la EM una relación mayor de comunicación directa hilio-fimbria que representa un alineamiento/reforzamiento de los tractos supervivientes respecto de los hipocampos contralaterales. Dichos hallazgos los interpretamos en el contexto de labilidad sináptica a nivel hipocampal anterior y sincronización del sistema hipocampal posterior que facilita la propagación de las crisis comiciales en los pacientes sometido a Epilepsia temporal de larga evolución. Fig.3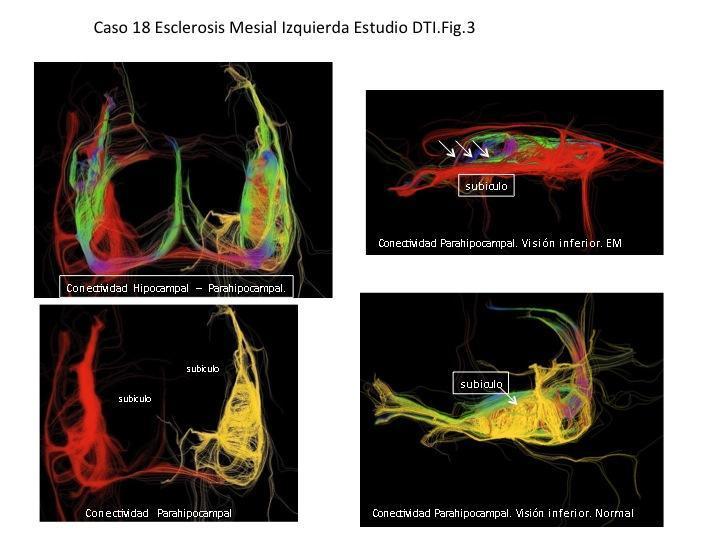
2.-Planificación de Cirugía.
Conectividad , Radiaciones Ópticas, Circuitos epilépticos
El estudio RM-DTI de la región temporal requerido para la planificación de la cirugía resectiva temporal debe de incluir la visualización de los tractos correspondientes al Fascículo Uncinado (FU), el Fascículo Longitudinal Inferior (FLI) y el Sistema Hipocampal/Parahipocampal.
El FU representa la conectividad del polo temporal anterior con la región frontoorbitaria a través del tallo temporal en la proximidad de la amígdala significando la conexión temporal anterior. El FLI muestra el importante grado de comunicación del lóbulo temporal con la región occipital y su relación con el sistema hipocampal. El FLI supone la conexión temporal posterior lateral del lóbulo temporal. Dicho tracto establece un importante grado de integración del procesamiento temporal a nivel de la convexidad en comunicación con el polo temporal.
La visualización del sistema hipocampal/parahipocampal representado por el Fascículo Cingular en el seno de la región parahipocampal muestra finalmente la conexión temporal posterior mesial. [Assaf (37) Wieshmann (38) Gong (39)]
La organización de las Radiaciones Ópticas (RO) a nivel del lóbulo Temporal cobra especial importancia en la cirugía resectiva temporal [Pierpaoli (2) Mori (10-12)]. Las RO se organizan constituyendo el llamado Loop de Meyer que discurre en el seno del lóbulo temporal. Dichos tractos pueden verse afectados en la cirugía resectiva temporal y/o en la extensión a la hipocampectomía resectiva. Las RO se organizan disponiéndose en el techo del ventrículo lateral a nivel temporal anterior. Posteriormente las RO alcanzan el cortex visual occipital disponiéndose lateralmente en la profundidad del lóbulo temporal (medialmente al FLI ). Existe por tanto una relación muy importante entre el ventrículo lateral a nivel temporal y las RO para ocupar una posición lateral a nivel del atrium ventricular. Existe una correlación entre la destrucción de la porción lateral e inferior del Loop de Meyer con los cambios campimétricos presentes en la cirugía temporal [Taoka (40) Hughes (41).Van Buren (42) Schorman (43-44)].
Uno de los aspectos más novedosos en el uso de la RM-DTI y su aplicación en el mundo de la Epilepsia es sin duda la posibilidad de visualizar los circuitos que se encuentran implicados en la propagación de las crisis comiciales. La extensión de las crisis desde el foco inicial utilizará la estructura tractográfica presente. Podemos valorar su activación en la propagación a distancia para explicar la semiología de las crisis y su papel en las alteraciones cognitivas presentadas.
La confluencia del mapeo cerebral mediante implante de electrodos subdurales/invasivos, el SISCOM y la posibilidad de generar tractos in situ permite generar de esta manera modelos de epilepsia. Fig.4
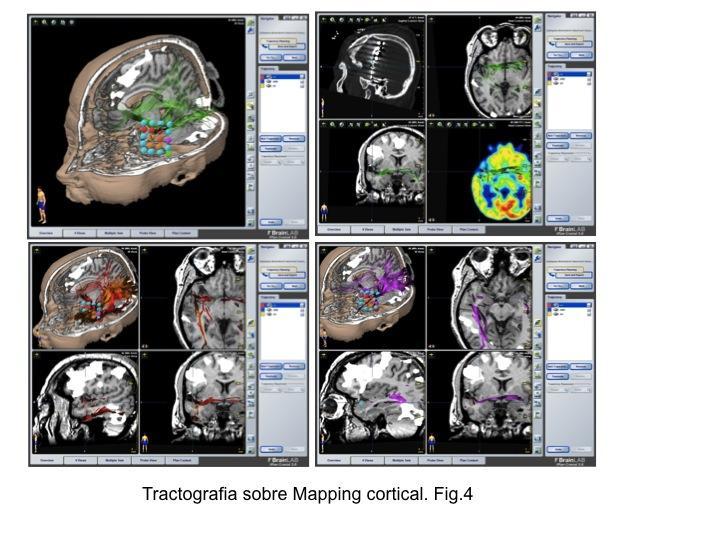
BIBLIOGRAFIA
1.-Le Bihan D, Mangin JF, Poupon C, Clark C, Pappata S, Molko N, and Chabriat H. Diffusion tensor imaging: concepts and applications.J Magn Reson Imag 2001;13:534–546
2.-Pierpaoli C, Jezzard P, Basser PJ, et al. Diffusion tensor MR imaging of the human brain. Radiology 1996;201:637–648Basser, P J. Inferring microstructural features and the physiological state of tissues from diffusion-weighted images. NMR Biomed, 1995. 8(7-8): p. 333-44
3.-.Basser, P J and Jones, D K. Diffusion-tensor MRI: theory, experimental design and data analysis - a technical review. NMR Biomed, 2002. 15(7-8): p. 456-67.
4.-Basser PJ, Pierpaoli C. A simplified method to measure the diffusiontensor from seven MR images. Magn Reson Med 1998;39:928–9344.
5.-Basser PJ, Pierpaoli C. Microstructural and physiological featuresof tissues elucidated by quantitative-diffusion-tensor MRI. J Magn Reson B 1996;111:209–219
6.-Jones DK, Simmons A, Williams SC, Horsfield MA. Non-invasive assessment of axonal fiber connectivity in the human brain via diffusion tensor MRI. Magn Reson Med 1999;42:37–41
7.-Fernández-Miranda, Juan C.; Rhoton, Albert L. Jr.; Álvarez-Linera, Juan; Kakizawa, Yukinari; Choi, Chanyoung; de Oliveira, Evandro P.Three-Dimensional Microsurgical and Tractographic Anatomy of the White Matter of the Human Brain Neurosurgery. 62(6):SHC989-SHC1028, June 2008.
8.-Arfanakis K, Hermann BP, Rogers BP, Carew JD, Seidenberg M,and Meyerand ME. Diffusion tensor MRI in temporal lobe epilepsy.Magn Reson Imag 2002;20:511–519
9.-Diehl B, Busch R, Duncan J Piao Z et al. 2008. Abnormalities in diffusion tensor imaging of the uncinate fasciculus relate to reduced memory in temporal lobe epilepsy. Epilepsia 1-10
10.-Mori S, Kaufmann WE, Davatzikos C, et al. Imaging cortical association tracts in the human brain using diffusion-tensor-based axonal tracking. Magn Reson Med 2002;47:215–223
11.-Mori S, van Zijl PC. Fiber tracking: principles and strategies: a technical review. NMR Biomed 2002;15:468–480
12.-Mori S, Crain BJ, Chacko VP, van Zijl PC. Three-dimensional tracking of axonal projections in the brain by magnetic resonance imaging. Ann Neurol 1999;45:265–269
13.-Engel J Jr. Outcome with respect to epileptic seizures. In: Engel J Jr, editor. Surgical treatment of the epilepsies. New York: Raven Press; 1987. p. 553–71.
14.-Jack CR. Neuroimaging of the temporal lobe. In: Luders HO,Comair YG, eds. Epilepsy Surgery. 2nd ed. Philadelphia: Lippincott, Williams & Wilkins; 2001
15.-Mikkonen M, Soininen H, Kalvianen R, Tapiola T, Ylinen A, Vapalahti M, et al. Remodeling of neuronal circuitries in human temporal lobe epilepsy: increased expression of highly 2093. Mori, S and van Zijl, P C. Fiber tracking: principles and strategies - a technical review. NMR Biomed, 2002. 15(7-8): p. 468-80. 04. 25(5): p. 670-6.
16.-Melhem ER, Mori S, Mukundan G, et al. Diffusion tensor MR imaging of the brain and white matter tractography. AJR Am J Roentgenol 2002;178:3–16
17.-Shepherd T, Özarslan E, King M, Mareci T, Blackband S. 2006. Structural insights from high-resolution diffusion tensor imaging and tractography of the isolated rat hippocampus. NeuroImage 32: 1499-1509.
18.-Shepherd T, Özarslan Yachnis A, King T, Blackband S. 2007. Diffusion tensor MicroscopyIndicates the Cytoarchitectural basis of Diffusion Anisotropphy in the human hippocampus.AJNR Am J Neuroradiol 28: 958-64
19.-Wieshmann UC, Clark CA, Symms MR, Barker GJ, Birnie KD, Shorvon SD. Water diffusion in the human hippocampus in epilepsy.Magn Reson Imaging 1999;17:29–36
20.-Concha, L, Beaulieu, C and Gross, D W. Bilateral limbic diffusion abnormalities in unilateral temporal lobe epilepsy. Ann Neurol, 2005. 57(2): p. 188-96.
21.-Concha L, Gross D, Beaulieu Ch.2005. Diffusion tensor Tractography of the Limbic System. aJNR Am 26: 2267-2274.
22.-Adachi, M., Kawakatsu S.,Hosoya T., et al. 2003. Morphology of the Inner Structure of the Hippocampal Formation in Alzheimer Disease. AJNR Am J Neuroradiol 24:1575-1581.
23.-Alsop DC, Connelly A, Duncan JS, Hufnagel A, Pierpaoli C, and Rugg-Gunn FJ. Diffusion and perfusion MRI in epilepsy. Epilepsia 2002;43(Suppl 1):69–77
24.-Wittner I, Eross L, Szabo Z, Toth S, Czirjak S, Halasz P, Freud TF, Magloczky ZS (2002). Synaptic reorganization of calbidin-positive neurons in the human hipocampal CA1 region in temporal lobe epilepsy. Neuroscience 115: 961-978.
25.-Maccaferri G, and McBain CJ. Passive propagation of LTD to stratum oriens-alveus inhibitory neurons modulates the temporoammonic input to the hippocampal CA1 region. Neuron 15: 137-145, 1995
26.-Soltesz I, and Jones RSG. Hippocampus forum: the direct perforant path input to CA1. Hippocampus 5: 101-146, 1995
27.-Lorente de Nó R. Studies on the structure of the cerebral cortex. II Continuationof the study of the ammonic system. J. Psychol Neurol 1934; 46: 114-177.
28.-Beaulieu C. The basis of anisotropic water diffusion in the nervous system: atechnical review. NMR Biomed 2002;15:435–55
29.-Babb TL. Pathology of the temporal hippocampal sclerosis. In:Luders HO and Comair YG. Epilepsy Surgery. 2nd ed. Philadelphia: Lippincott, Williams & Wilkins; 2001;901–906
30.-Babb TL, Pretorius JK, Kupfer WR, Crandall PH.Glutamate descarboxylase-immunoreactive neurons are preserved in human epileptic hippocampus. J. Neurosci 1989; 9:2562-2574.
31.-Babb TL, Kupfer WR, Pretorius JK. Recurrent excitatory circuits by sprouted mossy fibers into the fascia dentate of human epilepsy. Epilepsia 1988: 29:674.
32.-Babb TL, Kupfer WR, Pretorius JK, Crandall PH, Levesque MF. Synaptic reorganization by mossy fibers in the human epileptic fascia dentate. Neuroscience 1991; 42: 351-364.
33.-Babb TL, Kupfer WR, Pretorius JK, Crandall PH, Levesque MF. Synaptic reorganization by mossy fibers in human epileptic fascia dentata. Neuroscience 1991; 42: 351–63.
34.-Sutula T, Cascino G, Cavazos J, et al. Mossy fiber synaptic reorganization in the epileptic human temporal lobe. Ann Neurol 1989;26:321–30
35.-Represa A, Niquet J, Pollard H, Khrestchatisky M, Ben Ari Y. From seizures to neo-synaptogenesis: intrinsic and extrinsic determinants of mossy fiber sprouting in the adult hippocampus. Hippocampus 1994; 4: 270–4.
36.-Isokawa M, Levesque MF, Babb TL, Engel J Jr. Single mossy fiber axonal systems of human dentate granule cells studied in hippocampal slices from patients with temporal lobe epilepsy. J Neurosci 1993; 13: 1511–22.
37.-AssafBA, Mohamed FB, Abou-Khaled KJ, et al. Diffusion tensor imaging of the hippocampal formation in temporal lobe epilepsy, AJNR Am J Neuroradiol 2003; 24:1857-1862
38.-Wieshmann UC, Clark CA, Symms MR, Barker GJ, Birnie KD, Shorvon SD. Water diffusion in the human hippocampus in epilepsy.Magn Reson Imaging 1999;17:29–36
39.-Gong G, Jiang T, Zhu C, et al. Asymmetry analysis of cingulum based on scale-invariant parameterization by diffusion tensor imaging. Hum Brain Mapp 2005;24:92–9
40.-Taoka T, Sakamoto M, Nakagawa H, Nakase H. Iwaski Tayayama K, Taoka K, Hoshida T, Sakaki T, Kichikawa 2008. Diffusion Tensor Tractography of the Meyer loop in Cases of temporal Lobe Resection for Temporal lobe Epilepsy: Correlation between postsurgical visual field defect and anterior limit of Meyer loop on tractogrphy. AJNR Am J Neuroradiol 29:1329-34.
41.-Hughs TS, Abou-Khlil B, Lavin PJ, et al. Visual field defects after temporal lobe resection: a prospective quantitative analysis.Neurology 1999;53(1):167-172.
42.-Van Buren J, Baldwin M. The architecture of the optic radiation in the temporal lobe in man. Brain 1958;81:15-40
43.-Schormann, U, T, Schleicher, A and Zilles, K. Mapping of histologically identified long fiber tracts in human cerebral hemispheres to the MRI volume of a reference brain: position and spatial variability of the optic radiation. Neuroimage, 1999. 10(5): p. 489-99.
44.-Schmahmann, J D, Pandya, D N, Wang, R, Dai, G, D'Arceuil, H E, de Crespigny, A J and Wedeen, V J. Association fibre pathways of the brain: parallel observations from diffusion spectrum imaging and autoradiography. Brain, 2007. 130(Pt 3): p. 630-53. 35.

